دوره 11، شماره 1 - ( بهار 1403 )
جلد 11 شماره 1 صفحات 49-40 |
برگشت به فهرست نسخه ها
Ethics code: IR. bums. REC. 1399.174
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Norouzi R, Adnani Sadati S J, Ahmadi R, Afzalipour R, Siyadatpanah A, Sadeghinasab J et al . Seroprevalence of Toxoplasma Gondii Infection in Patients With Thyroid Dysfunction Compared to Healthy People in Yazd, Iran. J Prevent Med 2024; 11 (1) :40-49
URL: http://jpm.hums.ac.ir/article-1-756-fa.html
URL: http://jpm.hums.ac.ir/article-1-756-fa.html
نوروزی رقیه، عدنانی ساداتی سید جعفر، احمدی رضا، افضلی پور رضا، سیادت پناه ابوالقاسم، صادقی نسب جواد و همکاران.. بررسی شیوع آلودگی به توکسوپلاسما گوندی در بیماران دارای اختلال عملکرد تیروئید در استان یزد. طب پیشگیری. 1403; 11 (1) :40-49
رقیه نوروزی*1 

 ، سید جعفر عدنانی ساداتی2
، سید جعفر عدنانی ساداتی2 

 ، رضا احمدی3
، رضا احمدی3 

 ، رضا افضلی پور4
، رضا افضلی پور4 

 ، ابوالقاسم سیادت پناه5
، ابوالقاسم سیادت پناه5 

 ، جواد صادقی نسب6
، جواد صادقی نسب6 

 ، احمد نگهبان7
، احمد نگهبان7 




 ، سید جعفر عدنانی ساداتی2
، سید جعفر عدنانی ساداتی2 

 ، رضا احمدی3
، رضا احمدی3 

 ، رضا افضلی پور4
، رضا افضلی پور4 

 ، ابوالقاسم سیادت پناه5
، ابوالقاسم سیادت پناه5 

 ، جواد صادقی نسب6
، جواد صادقی نسب6 

 ، احمد نگهبان7
، احمد نگهبان7 


1- گروه پاتوبیولوژی، دانشکده دامپزشکی، دانشگاه تبریز، تبریز، ایران.
2- گروه میکروب شناسی، ایمنی شناسی و انگل شناسی، دانشکده پزشکی، دانشگاه علومپزشکی قم، قم، ایران.
3- گروه طب داخلی، مرکز تحقیقات بیماریهای عفونی، دانشکده پزشکی، دانشگاه علومپزشکی گناباد، گناباد، ایران.
4- مرکز تحقیقات پزشکی مولکولی، پژوهشکده سلامت هرمزگان، دانشگاه علومپزشکی هرمزگان، بندرعباس، ایران.
5- گروه میکروبشناسی، مرکز تحقیقات بیماریهای عفونی، دانشکده پزشکی، دانشگاه علومپزشکی گناباد، گناباد، ایران.
6- گروه اطفال، دانشکده پزشکی، دانشگاه علومپزشکی گناباد، گناباد، ایران.
7- گروه فناوری اطلاعات سلامت، دانشکده علومپزشکی فردوس، دانشگاه علومپزشکی بیرجند، بیرجند، ایران.
2- گروه میکروب شناسی، ایمنی شناسی و انگل شناسی، دانشکده پزشکی، دانشگاه علومپزشکی قم، قم، ایران.
3- گروه طب داخلی، مرکز تحقیقات بیماریهای عفونی، دانشکده پزشکی، دانشگاه علومپزشکی گناباد، گناباد، ایران.
4- مرکز تحقیقات پزشکی مولکولی، پژوهشکده سلامت هرمزگان، دانشگاه علومپزشکی هرمزگان، بندرعباس، ایران.
5- گروه میکروبشناسی، مرکز تحقیقات بیماریهای عفونی، دانشکده پزشکی، دانشگاه علومپزشکی گناباد، گناباد، ایران.
6- گروه اطفال، دانشکده پزشکی، دانشگاه علومپزشکی گناباد، گناباد، ایران.
7- گروه فناوری اطلاعات سلامت، دانشکده علومپزشکی فردوس، دانشگاه علومپزشکی بیرجند، بیرجند، ایران.
متن کامل [PDF 3010 kb]
(865 دریافت)
| چکیده (HTML) (2190 مشاهده)
References
1.Dubey JP, Darrington C, Tiao N, Ferreira LR, Choudhary S, Molla B, et al. Isolation of viable Toxoplasma gondii from tissues and feces of cats from Addis Ababa, Ethiopia. J Parasitol. 2013; 99(1):56-8. [DOI:10.1645/GE-3229.1] [PMID]
2.Asgari Q, Mehrabani D, Motazedian M, Kalantari M, Nouroozi J, Adnani Sadati S. The viability and infectivity of Toxoplasma gondii tachyzoites in dairy products undergoing food processing. Asian J Anim Sci. 2011; 5(3):202-7. [DOI:10.3923/ajas.2011.202.207]
3.Pappas G, Roussos N, Falagas ME. Toxoplasmosis snapshots: Global status of Toxoplasma gondii seroprevalence and implications for pregnancy and congenital toxoplasmosis. Int J Parasitol. 2009; 39(12):1385-94. [DOI:10.1016/j.ijpara.2009.04.003] [PMID]
4.Mohaghegh MA, Yazdani H, Hadipour M, Namdar F, Azami M, Kalani H, et al. Seroprevalence of Toxoplasma gondii infection among patients admitted to Al-Zahra Hospital, Isfahan, Iran. J Ayub Med Coll Abbottabad. 2015; 27(4):767-70. [PMID]
5.Omidian M, Asgari Q, Bahreini MS, Moshki S, Sedaghat B, Adnani Sadati SJ. Acute toxoplasmosis can increase serum dopamine level. J Parasitic Dis. 2022; 46(2):337-42. [DOI:10.1007/s12639-021-01447-1] [PMID]
6.Dubey JP. History of the discovery of the life cycle of Toxoplasma gondii. Int J Parasitol. 2009; 39(8):877-82. [DOI:10.1016/j.ijpara.2009.01.005] [PMID]
7.Scallan E, Hoekstra RM, Angulo FJ, Tauxe RV, Widdowson MA, Roy SL, et al. Foodborne illness acquired in the United States- Major pathogens. Emerg Infect Dis. 2011; 17(1):7-15. [DOI:10.3201/eid1701.P11101] [PMID]
8.Bresciani KDS, Galvão ALB, Vasconcellos ALd, Soares JA, Matos LVSd, Pierucci JC, et al. Relevant aspects of human toxoplasmosis. Res J Infect Dis. 2013; 1(1):1-7. [Link]
9.Asgari Q, Sarnevesht J, Kalantari M, Sadat SJ, Motazedian MH, Sarkari B. Molecular survey of Toxoplasma infection in sheep and goat from Fars province, Southern Iran. Trop Anim Health Prod. 2011; 43(2):389-92. [DOI:10.1007/s11250-010-9704-1] [PMID]
10.Dubey JP, Jones JL. Toxoplasma gondii infection in humans and animals in the United States. Int J Parasitol. 2008; 38(11):1257-78. [DOI:10.1016/j.ijpara.2008.03.007] [PMID]
11.Flegr J, Prandota J, Sovičková M, Israili ZH. Toxoplasmosis-a global threat. Correlation of latent toxoplasmosis with specific disease burden in a set of 88 countries. Plos One. 2014; 9(3):e90203. [DOI:10.1371/journal.pone.0090203] [PMID]
12.Zouei N, Shojaee S, Mohebali M, Keshavarz H. The association of latent toxoplasmosis and level of serum testosterone in humans. BMC Res Notes. 2018; 11(1):365. [DOI:10.1186/s13104-018-3468-5] [PMID]
13.Boelaert K, Franklyn JA. Thyroid hormone in health and disease. J Endocrinol. 2005; 187(1):1-15. [DOI:10.1677/joe.1.06131] [PMID]
14.Wasserman EE, Nelson K, Rose NR, Rhode C, Pillion JP, Seaberg E, et al. Infection and thyroid autoimmunity: A seroepidemiologic study of TPOaAb. Autoimmunity. 2009; 42(5):439-46. [DOI:10.1080/08916930902787716] [PMID]
15.Alvarado-Esquivel C, Torres-Castorena A, Liesenfeld O, García-López CR, Estrada-Martínez S, Sifuentes-Alvarez A, et al. Seroepidemiology of Toxoplasma gondii infection in pregnant women in rural Durango, Mexico. J Parasitol. 2009; 95(2):271-4. [DOI:10.1645/GE-1829.1] [PMID]
16.Liu DC, Lin CS, Seshan V. [AIDS complicated with disseminated toxoplasmosis: A pathological study of 9 autopsy cases (Chinese)]. Zhonghua Bing Li Xue Za Zhi. 1994; 23(3):166-9. [PMID]
17.Tozzoli R, Barzilai O, Ram M, Villalta D, Bizzaro N, Sherer Y, et al. Infections and autoimmune thyroid diseases: Parallel detection of antibodies against pathogens with proteomic technology. Autoimmun Rev. 2008; 8(2):112-5. [DOI:10.1016/j.autrev.2008.07.013] [PMID]
18.Stahl W, Kaneda Y. Impaired thyroid function in murine toxoplasmosis. Parasitology. 1998; 117 (Pt 3):217-22. [DOI:10.1017/S003118209800300X] [PMID]
19.Salman Y, Mustafa WG. Correlation between Toxoplasma gondii and Thyroid function hormone levels in sera of patients attending private clinics and laboratories in Kirkuk City. Int J Plant Biol. 2014; 1(4):299-306. [Link]
20.Al-Ezzy AIA, Abood WN. Immunoenocrinology Association of toxoplasma gondii and thyroid hormins in Iraqi Patients with clinical manifestatons of toxoplasmosis. Int J Pharma Bio Sci. 2016; 7(1):359-69. [Link]
21.Alvarado-Esquivel C, Ramos-Nevarez A, Guido-Arreola CA, Cerrillo-Soto SM, Pérez-Álamos AR, Estrada-Martínez S, et al. Association between Toxoplasma gondii infection and thyroid dysfunction: A case-control seroprevalence study. BMC Infect Dis. 2019; 19(1):826. [DOI:10.1186/s12879-019-4450-0] [PMID]
22.Al-Issawi TAM, Mohammed AS. Effects of Infection with Toxoplasma Gondii to the Levels of Thyroid Hormones. Eur J Mol Clin Med. 2020; 7(1):110-4. [Link]
متن کامل: (1731 مشاهده)
مقدمه
توکسوپلاسموز انسانی یک عفونت زئونوز است که توسط تکیاخته داخل سلولی توکسوپلاسما گوندی ایجاد میشود. توکسوپلاسموزیس بهعنوان یک عفونت انگلی بسیار گسترده در کشورهای توسعهیافته و درحالتوسعه گزارش شده است. اگرچه شیوع توکسوپلاسموزیس در کشورهای مختلف متفاوت است، ولی تخمین زده شده است که بیش از یکسوم جمعیت جهان در معرض این انگل قرار گرفتهاند [1 ,2]. شیوع جهانی توکسوپلاسموزیس در زنان باردار 32/9 درصد گزارش شده است. این تکیاخته دارای چرخه زندگی پیچیدهای است، ازجمله تکثیر جنسی در گربه، گربهسانان اهلی یا وحشی بهعنوان میزبان قطعی و چرخه غیرجنسی در انواع پستانداران، ازجمله انسان [3, 4].
توکسوپلاسما گوندی عمدتاً ازطریق آب آشامیدنی، خوردن غذای آلوده با اووسیستهای اسپوردار آزادشده توسط میزبان قطعی یا با خوردن گوشت خام یا نیمپز حاوی کیست منتقل میشود [4 ,5, 6]. همچنین راههای دیگر مبتلا شدن به این تکیاخته عبارتاند از: انتقال عمودی در دوران بارداری (از مادر به کودک)، پیوند عضو، انتقال خون و استنشاق گردوغبار آلوده به اووسیست [7, 8].
توکسوپلاسموز حاد در افراد سالم بهخاطر پاسخهای ایمنی مؤثر، معمولاً در اکثر مواقع بدون علامت بالینی است، اما ممکن است منجر به عفونت مزمن شود. بااینحال، توکسوپلاسموز میتواند منجر به مشکلات شدید و حتی مرگ در بیماران مبتلا به ایدز، گیرندگان پیوند و بیماران سرطانی شود [9, 10]. ابتلا به این انگل با تعدادی از اختلالات آسیبشناسی، ازجمله اختلالات غدد درونریز مرتبط است. بهعنوان مثال، توکسوپلاسموز میتواند سطح متوسط تستوسترون در سرم انسان را تغییر دهد [11, 12].
تیروئید یک غده درونریز است که هورمونهای تیروکسین (T4) و تری یدوتیرونین (T3) را سنتز میکند و آنها را در خون آزاد کرده و تقریباً بر تمام فرایندهای متابولیک در بدن تأثیر میگذارد [13]. مطالعات نشان دادهاند شیوع آنتیبادی IgG ضد توکسوپلاسما در بیماران مبتلا به خودایمنی تیروئید مشهود بوده است و انگل میتواند با تولید هورمونهای تیروئید تداخل داشته باشد. فرضیه شباهت بین اتوآنتی ژنهای تیروئید انسان و اجزای مولکولی توکسوپلاسما گوندی ممکن است رابطه بین اختلال عملکرد تیروئید و این میکروارگانیسم را توجیه کند [14].
باتوجهبه تعداد کم مطالعات درمورد ارتباط عفونت توکسوپلاسموزیس با اختلالات هورمونهای تیروئیدی، مطالعه حاضر با هدف بررسی ارتباط بین مثبت بودن سرمی آنتیبادی IgG ضد توکسوپلاسما گوندی و اختلال عملکرد تیروئید در بیماران شهر یزد انجام گرفت.
مواد و روشها
این مطالعه موردشاهدی طی سالهای 1397 تا 1398 در یکی از مراکز درمانی شهر یزد انجام شد. درمجموع 82 بیمار (78 زن و 4 مرد) و 801 فرد سالم (747 زن و 54 مرد) در مطالعه حاضر وارد شدند. گروه کنترل از بین افرادی که به آزمایشگاه بالینی مرکز پزشکی شهر یزد مراجعه کرده بودند و ازنظر کمکاری و پرکاری تیروئید منفی بودند، انتخاب شدند. معیار ورود به مطالعه افراد 15 سال به بالا با سابقه کمکاری یا پرکاری تیروئید بود.
نمونهگیری و آنالیز سرولوژی
نمونه خون (5 میلیلیتر) از هر شرکتکننده اخذ شد و به مدت 2 ساعت در دمای اتاق باقی ماند تا لخته شود. سپس نمونهها با سرعت 3000 دور در دقیقه به مدت 10 دقیقه سانتریفیوژ شدند تا سرم به دست آید. سرم جمعآوریشده تا زمان استفاده در دمای منفی 20- درجه سانتیگراد نگهداری شد. تشخیص آنتیبادی IgG ضد توکسوپلاسما و هورمونهای تیروئید تری یدوتیرونین، تیروکسین و تیروتروپین توسط کیتهای تجاری استاندارد تست الایزا (شرکت تشخیصی پیشتاز طب، تهران، ایران) انجام شد. براساس دستورالعمل شرکت سازنده کیت، چگالی نوری آنتیبادی IgG و هورمونهای تیروئیدی در طول موج 450 نانومتر پس از 15 دقیقه با استفاده از دستگاه میکروپلیت خوان خودکار (State Fax® 2100) (Awareness, Chicago, USA) خوانده شد. پس از آن، مقدار cut-off value تست الایزا برای نتایج مثبت و منفی تعیین شد. تیترهای بالای آنتیبادی IgG ضد توکسوپلاسما گوندی بیش از 200 واحد بینالمللی در میلیلیتر در بیماران مبتلا به کمبود تیروئید، مثبت و تیترهای پایینتر از 200 واحد بینالمللی در میلیلیتر، منفی در نظر گرفته شد.
آنالیزآماری
جهت تجزیهوتحلیل دادهها از نرمافزار آماری Microsoft Excel استفاده شد. نسبت شانس (ORs) و فاصله اطمینان 95 درصد (CI) برای تخمین خطر عفونت توسط توکسوپلاسما استفاده شد (P<0/05) OR > 1 نشاندهنده تأثیر مثبت توکسوپلاسما بر اختلال عملکرد تیروئید و OR<1 نشاندهنده اثر محافظتی عفونت توکسوپلاسما در برابر اختلال عملکرد تیروئید است.
یافتهها
در این مطالعه، آنتی بادی IgG ضد توکسوپلاسما گوندی در 12 نفر (14/63 درصد) از 82 بیمار مبتلا به اختلال عملکرد تیروئید و در 146 نفر (18/23 درصد) از 801 فرد سالم (گروه کنترل) یافت شد. هیچ تفاوت آماری معنیداری در شیوع سرمی آنتیبادی IgG ضد توکسوپلاسما در بیماران مبتلا به اختلال عملکرد تیروئید در مقایسه با افراد سالم مشاهده نشد ((OR=0/77؛ 95% CI: 0/37–1/47؛ P=0/54)). در جدول شماره 1 دادهها بر اساس متغیرهای جنس و سن ارائه شده است.
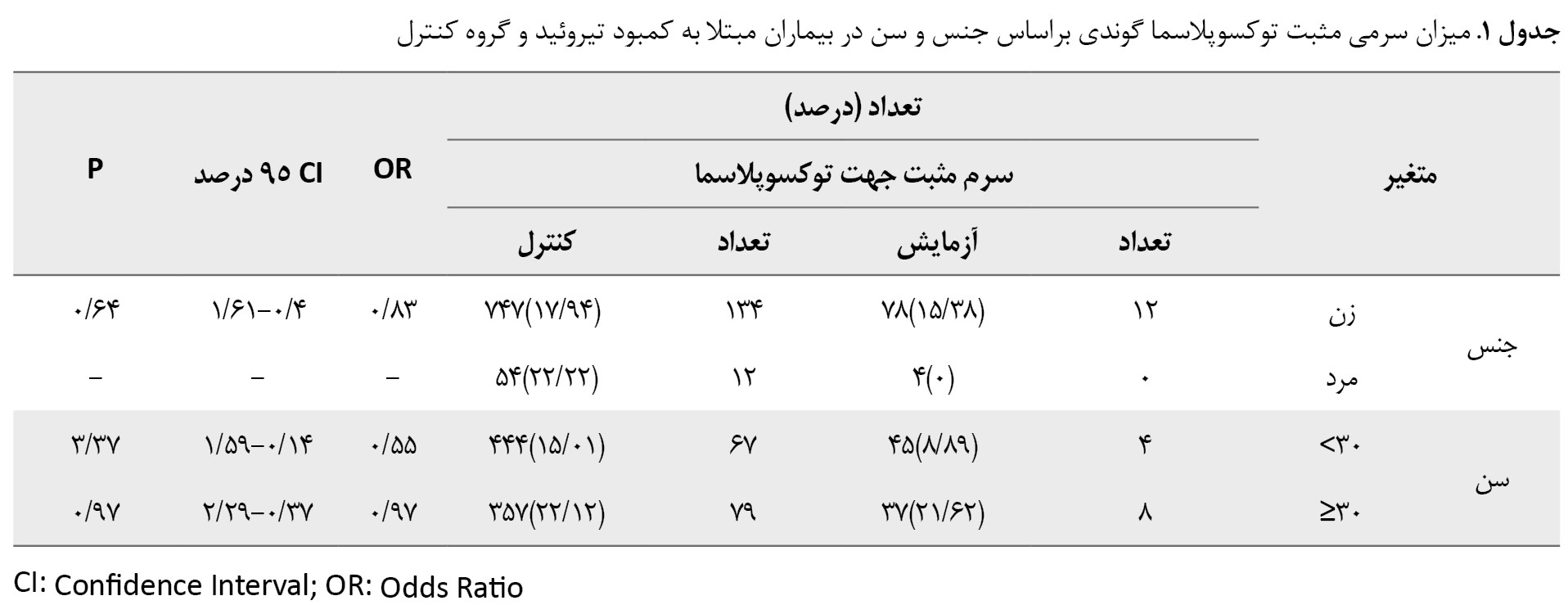
فراوانی تیترهای بالای آنتیبادی IgG ضد توکسوپلاسما گوندی بیش از 200 واحد بینالمللی در میلیلیتر در بیماران مبتلا به کمبود تیروئید مشابه گروه کنترل سالم بود (P=0/25 و 4/15-0/95 :95%CI ؛OR=1/79 ؛33/801 و 6/82). علاوهبراین، فراوانی مقادیر بالای آنتیبادی IgG ضد توکسوپلاسما گوندی (بیش از 200 واحد بینالمللی در میلیلیتر) در بیماران مبتلا به کمکاری تیروئید و پرکاری تیروئید به ترتیب 34/3 و 33/801؛ OR= 2: 0/78-7/46 و P=0/057 و 5/48 و 33/801؛ OR=2/7 و 95% CI: 0/78-7/46 و P=0/057 مشابه گروه کنترل بود. نتایج تجزیهوتحلیل آماری نشان داد بین شیوع سرمی توکسوپلاسما در افراد مبتلا به کمکاری تیروئید و گروه کنترل تفاوتی وجود ندارد (P=0/54). 6 نفر (12/5 درصد) از 48 بیمار مبتلا به پرکاری تیروئید ازنظر آنتیبادی ضد توکسوپلاسما مثبت بودند. بنابراین این یافته تفاوتی بین شیوع سرمی عفونت با توکسوپلاسما گوندی در بیماران مبتلا به پرکاری تیروئید و گروه کنترل نشان نداد (P=0/99).
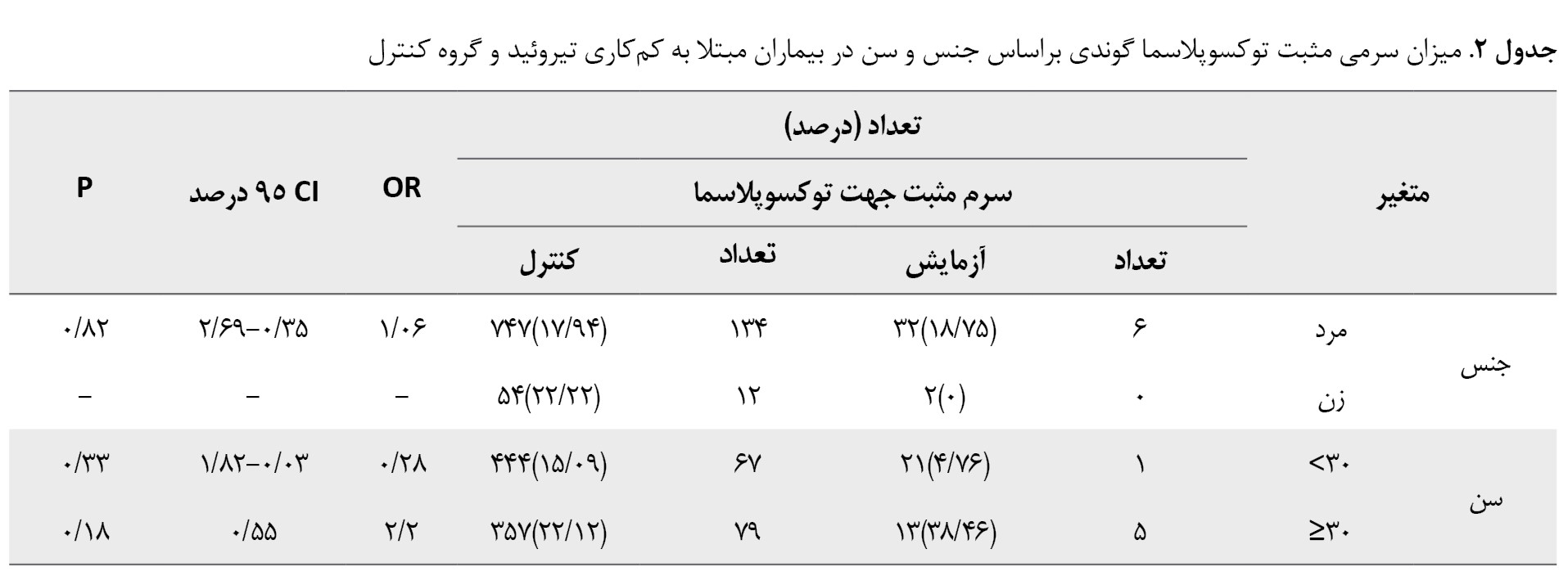
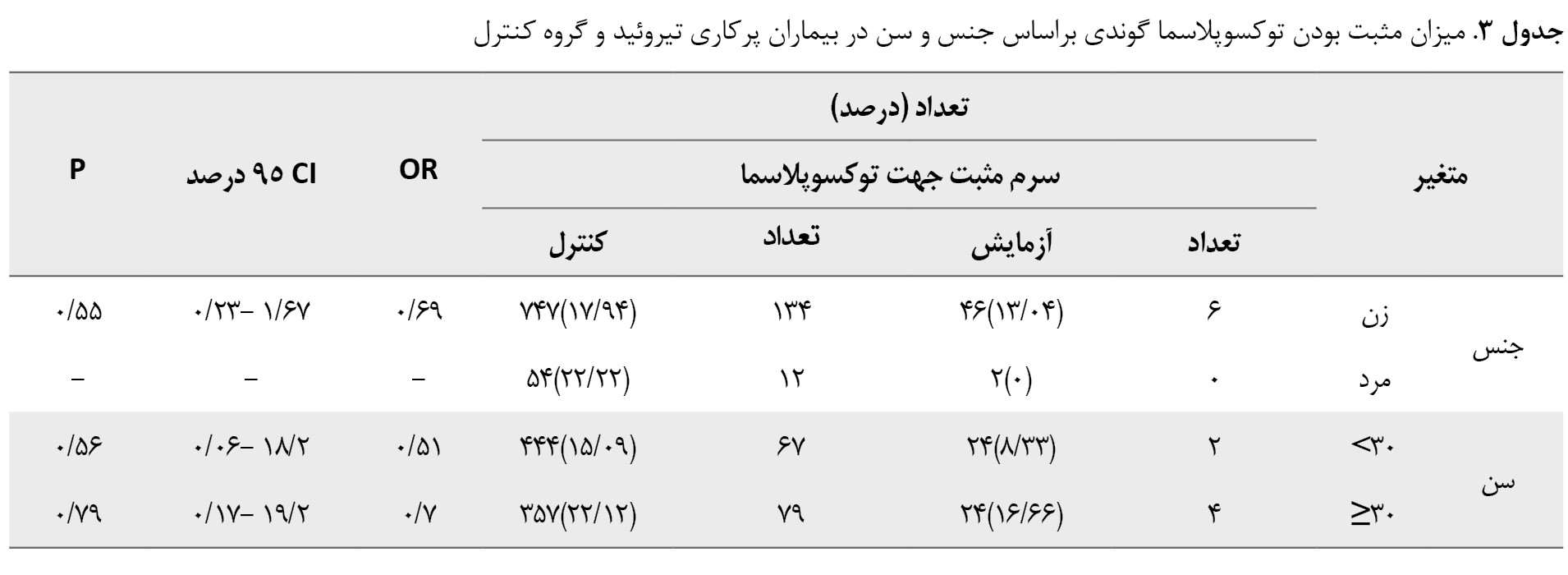
بهطورکلی، شیوع سرمی عفونت با توکسوپلاسما در بیماران مبتلا به کمکاری تیروئید بیشتر از بیماران مبتلا به پرکاری تیروئید بود، اما همبستگی معنی داری مشاهده نشد (P=0/54). طبقهبندی بیشتر بیماران براساس جنسیت و گروههای سنی در کمکاری تیروئید و پرکاری تیروئید نیز تفاوت ناچیزی را بین بیماران و گروه کنترل نشان داد (P=0/05) (جدولهای شماره 2 و 3).
بحث و نتیجهگیری
انگل توکسوپلاسما گوندی ممکن است انسان و همچنین گونههای دیگر، ازجمله تمام مهرهداران را آلوده کند [4]. تاکی زوئیتهای انگل میتوانند ازطریق گردش خون به اندامهایی مانند غده تیروئید برسند و با ایجاد تغییرات بافتی، مانند هیپرپلازی بر عملکرد تیروئید تأثیر بگذارند که در اهمیت این مطالعه منعکس شده است [11]. تفاوت در میزان آلودگی به توکسوپلاسما تحت تأثیر آبوهوای گرم و مرطوب، آب آلوده، عوامل مرتبط با غذا (عادات بد آشپزی)، بهداشت بد و تماس با حیوانات ولگرد است که میتوانند ناقلان بالقوه انگل باشند [8]. بااینحال، ارتباط بین عفونت توسط انگل با غده تیروئید تا حد زیادی ناشناخته و نامشخص است. در مطالعه حاضر، شیوع توکسوپلاسموز نهفته در افراد شهر یزد و آنتیبادیهای IgG ضد توکسوپلاسما در بیماران مبتلا به کمکاری و پرکاری تیروئید در مقایسه با گروههای کنترل بررسی شد. براساس نتایج این مطالعه، متغیرهای جنس و سن در شیوع عفونت توکسوپلاسما و اختلال عملکرد تیروئید ارتباطی نداشتند. تحقیقات انجامشده در 88 کشور یک رابطه کلی مثبت بین شیوع توکسوپلاسموز نهفته و بروز اختلالات غدد درونریز را نشان داد [15]. علاوهبراین، عفونت توکسوپلاسموزیس در غده تیروئید در انسان [16] و سایر مهرهداران [1] گزارش شده است. توکسوپلاسموز با بیماریهای خودایمنی تیروئید [15، 17]، افزایش اتوآنتی بادیها علیه پراکسیداز تیروئید [14] و افزایش خفیف در سنتز هورمون تیروئید در دوران بارداری مرتبط است [17]. سلمان و همکاران، فراوانی (15/85 درصد) آنتی بادی را در سرم بیماران مبتلا به عملکرد غیرطبیعی تیروئید گزارش کردند که در آنها 13 درصد آنتیبادی IgG و 2/84 درصد آنتیبادی IgM ضد توکسوپلاسما مثبت بود [18, 19].
در مقابل آلوارادو ـ اسکوویل و همکاران گزارش کردند شیوع سرمی عفونت با توکسوپلاسما گوندی بیماران مبتلا به کمکاری تیروئید بین 31 تا 50 سال در مقایسه با افراد گروه کنترل بهطور قابلتوجهی کمتر بود و این ارتباط منفی غیرمنتظره بود [14].
ابود و الیزی گزارش کردند پاسخهای مثبت IgM و IgG توکسوپلاسما گوندی بهطور قابلتوجهی با جنسیت مرتبط است و تری یدوتیرونین و تیروکسین با پاسخ مثبت IgM ضد توکسوپلاسما در زنان همبستگی معکوس داشت و تفاوت معنیداری در سطح تری یدوتیرونین در بین مردان و زنان دارای آنتی IgM و IgG مثبت در سرم گزارش کردند. در این مطالعه نشان داده شد شیوع سرمی عفونت با توکسوپلاسما در بیماران مبتلا به کمکاری تیروئید بیشتر از بیماران مبتلا به پرکاری تیروئید بود، اما تفاوت معنیداری مشاهده نشد [20].
مطالعه دیگری برای تعیین ارتباط بین مثبت شدن سرمی عفونت توکسوپلاسما گوندی و بیماری تیروئید طراحی شد. از 176 بیمار، 161 نفر مبتلا به کمکاری تیروئید و 15 نفر مبتلا به پرکاری تیروئید ناشی از توکسوپلاسما گوندی بودند. بیماران به 2 گروه وابسته به سن یعنی 50 سال و 51 سال به بالا تقسیم شدند. اگرچه بین عفونت توکسوپلاسما گوندی و بیماری تیروئید همبستگی منفی وجود دارد. کمکاری تیروئید در بیماران جوانتر در مقایسه با گروه مسنتر مشاهده شد [21].
در مطالعه دیگری آیسر صالح محمد و همکاران برای تعیین اثر توکسوپلاسموز بر سطح هورمون تیروئید از تست الایزا استفاده کردند و یافتههای آنها نشان داد درمورد کمکاری تیروئید، افزایش معنیداری در سطح تیروتروپین و کاهش تیروکسین، تری یدوتیرونین و کلسیتونین در مقایسه با گروه کنترل مشاهده شد. از سوی دیگر، کاهش در سطح تیروتروپین و افزایش قابلتوجهی در سطوح تیروکسین، تری یدوتیرونین و کلسی تونین درمورد پرکاری تیروئید وجود داشت[22].
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه دارای تأییدیه اخلاقی به شماره (IR. bums. REC. 1399.174) از دانشگاه علومپزشکی بیرجند است.
حامی مالی
این مقاله با حمایت مالی معاونت تحقیقات دانشگاه دانشگاه علومپزشکی بیرجند انجام شده است.
مشارکت نویسندگان
مفهومسازی: رقیه نوروزی، ابوالقاسم سیادتپناه؛ روششناسی: رقیه نوروزی، سید جعفر عدنانی ساداتی؛ تحقیق: رقیه نوروزی، رضا احمدی؛ نگارش پیشنویس اصلی: رضا افضلیپور، جواد صادقینسب; نقد و ویرایش: رقیه نوروزی، احمد نگهبان؛ تأمین مالی، ابوالقاسم سیادتپناه؛ منابع: ابوالقاسم سیادتپناه؛ سرپرستی: رقیه نوروزی، ابوالقاسم سیادتپناه.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از کلیه همکاران شاغل در معاونت تحقیقات و فناوری دانشگاه علومپزشکی بیرجند و بخش انگلشناسی برای کمکهای صورتگرفته تشکر و قدردانی میکنند.
توکسوپلاسموز انسانی یک عفونت زئونوز است که توسط تکیاخته داخل سلولی توکسوپلاسما گوندی ایجاد میشود. توکسوپلاسموزیس بهعنوان یک عفونت انگلی بسیار گسترده در کشورهای توسعهیافته و درحالتوسعه گزارش شده است. اگرچه شیوع توکسوپلاسموزیس در کشورهای مختلف متفاوت است، ولی تخمین زده شده است که بیش از یکسوم جمعیت جهان در معرض این انگل قرار گرفتهاند [1 ,2]. شیوع جهانی توکسوپلاسموزیس در زنان باردار 32/9 درصد گزارش شده است. این تکیاخته دارای چرخه زندگی پیچیدهای است، ازجمله تکثیر جنسی در گربه، گربهسانان اهلی یا وحشی بهعنوان میزبان قطعی و چرخه غیرجنسی در انواع پستانداران، ازجمله انسان [3, 4].
توکسوپلاسما گوندی عمدتاً ازطریق آب آشامیدنی، خوردن غذای آلوده با اووسیستهای اسپوردار آزادشده توسط میزبان قطعی یا با خوردن گوشت خام یا نیمپز حاوی کیست منتقل میشود [4 ,5, 6]. همچنین راههای دیگر مبتلا شدن به این تکیاخته عبارتاند از: انتقال عمودی در دوران بارداری (از مادر به کودک)، پیوند عضو، انتقال خون و استنشاق گردوغبار آلوده به اووسیست [7, 8].
توکسوپلاسموز حاد در افراد سالم بهخاطر پاسخهای ایمنی مؤثر، معمولاً در اکثر مواقع بدون علامت بالینی است، اما ممکن است منجر به عفونت مزمن شود. بااینحال، توکسوپلاسموز میتواند منجر به مشکلات شدید و حتی مرگ در بیماران مبتلا به ایدز، گیرندگان پیوند و بیماران سرطانی شود [9, 10]. ابتلا به این انگل با تعدادی از اختلالات آسیبشناسی، ازجمله اختلالات غدد درونریز مرتبط است. بهعنوان مثال، توکسوپلاسموز میتواند سطح متوسط تستوسترون در سرم انسان را تغییر دهد [11, 12].
تیروئید یک غده درونریز است که هورمونهای تیروکسین (T4) و تری یدوتیرونین (T3) را سنتز میکند و آنها را در خون آزاد کرده و تقریباً بر تمام فرایندهای متابولیک در بدن تأثیر میگذارد [13]. مطالعات نشان دادهاند شیوع آنتیبادی IgG ضد توکسوپلاسما در بیماران مبتلا به خودایمنی تیروئید مشهود بوده است و انگل میتواند با تولید هورمونهای تیروئید تداخل داشته باشد. فرضیه شباهت بین اتوآنتی ژنهای تیروئید انسان و اجزای مولکولی توکسوپلاسما گوندی ممکن است رابطه بین اختلال عملکرد تیروئید و این میکروارگانیسم را توجیه کند [14].
باتوجهبه تعداد کم مطالعات درمورد ارتباط عفونت توکسوپلاسموزیس با اختلالات هورمونهای تیروئیدی، مطالعه حاضر با هدف بررسی ارتباط بین مثبت بودن سرمی آنتیبادی IgG ضد توکسوپلاسما گوندی و اختلال عملکرد تیروئید در بیماران شهر یزد انجام گرفت.
مواد و روشها
این مطالعه موردشاهدی طی سالهای 1397 تا 1398 در یکی از مراکز درمانی شهر یزد انجام شد. درمجموع 82 بیمار (78 زن و 4 مرد) و 801 فرد سالم (747 زن و 54 مرد) در مطالعه حاضر وارد شدند. گروه کنترل از بین افرادی که به آزمایشگاه بالینی مرکز پزشکی شهر یزد مراجعه کرده بودند و ازنظر کمکاری و پرکاری تیروئید منفی بودند، انتخاب شدند. معیار ورود به مطالعه افراد 15 سال به بالا با سابقه کمکاری یا پرکاری تیروئید بود.
نمونهگیری و آنالیز سرولوژی
نمونه خون (5 میلیلیتر) از هر شرکتکننده اخذ شد و به مدت 2 ساعت در دمای اتاق باقی ماند تا لخته شود. سپس نمونهها با سرعت 3000 دور در دقیقه به مدت 10 دقیقه سانتریفیوژ شدند تا سرم به دست آید. سرم جمعآوریشده تا زمان استفاده در دمای منفی 20- درجه سانتیگراد نگهداری شد. تشخیص آنتیبادی IgG ضد توکسوپلاسما و هورمونهای تیروئید تری یدوتیرونین، تیروکسین و تیروتروپین توسط کیتهای تجاری استاندارد تست الایزا (شرکت تشخیصی پیشتاز طب، تهران، ایران) انجام شد. براساس دستورالعمل شرکت سازنده کیت، چگالی نوری آنتیبادی IgG و هورمونهای تیروئیدی در طول موج 450 نانومتر پس از 15 دقیقه با استفاده از دستگاه میکروپلیت خوان خودکار (State Fax® 2100) (Awareness, Chicago, USA) خوانده شد. پس از آن، مقدار cut-off value تست الایزا برای نتایج مثبت و منفی تعیین شد. تیترهای بالای آنتیبادی IgG ضد توکسوپلاسما گوندی بیش از 200 واحد بینالمللی در میلیلیتر در بیماران مبتلا به کمبود تیروئید، مثبت و تیترهای پایینتر از 200 واحد بینالمللی در میلیلیتر، منفی در نظر گرفته شد.
آنالیزآماری
جهت تجزیهوتحلیل دادهها از نرمافزار آماری Microsoft Excel استفاده شد. نسبت شانس (ORs) و فاصله اطمینان 95 درصد (CI) برای تخمین خطر عفونت توسط توکسوپلاسما استفاده شد (P<0/05) OR > 1 نشاندهنده تأثیر مثبت توکسوپلاسما بر اختلال عملکرد تیروئید و OR<1 نشاندهنده اثر محافظتی عفونت توکسوپلاسما در برابر اختلال عملکرد تیروئید است.
یافتهها
در این مطالعه، آنتی بادی IgG ضد توکسوپلاسما گوندی در 12 نفر (14/63 درصد) از 82 بیمار مبتلا به اختلال عملکرد تیروئید و در 146 نفر (18/23 درصد) از 801 فرد سالم (گروه کنترل) یافت شد. هیچ تفاوت آماری معنیداری در شیوع سرمی آنتیبادی IgG ضد توکسوپلاسما در بیماران مبتلا به اختلال عملکرد تیروئید در مقایسه با افراد سالم مشاهده نشد ((OR=0/77؛ 95% CI: 0/37–1/47؛ P=0/54)). در جدول شماره 1 دادهها بر اساس متغیرهای جنس و سن ارائه شده است.

فراوانی تیترهای بالای آنتیبادی IgG ضد توکسوپلاسما گوندی بیش از 200 واحد بینالمللی در میلیلیتر در بیماران مبتلا به کمبود تیروئید مشابه گروه کنترل سالم بود (P=0/25 و 4/15-0/95 :95%CI ؛OR=1/79 ؛33/801 و 6/82). علاوهبراین، فراوانی مقادیر بالای آنتیبادی IgG ضد توکسوپلاسما گوندی (بیش از 200 واحد بینالمللی در میلیلیتر) در بیماران مبتلا به کمکاری تیروئید و پرکاری تیروئید به ترتیب 34/3 و 33/801؛ OR= 2: 0/78-7/46 و P=0/057 و 5/48 و 33/801؛ OR=2/7 و 95% CI: 0/78-7/46 و P=0/057 مشابه گروه کنترل بود. نتایج تجزیهوتحلیل آماری نشان داد بین شیوع سرمی توکسوپلاسما در افراد مبتلا به کمکاری تیروئید و گروه کنترل تفاوتی وجود ندارد (P=0/54). 6 نفر (12/5 درصد) از 48 بیمار مبتلا به پرکاری تیروئید ازنظر آنتیبادی ضد توکسوپلاسما مثبت بودند. بنابراین این یافته تفاوتی بین شیوع سرمی عفونت با توکسوپلاسما گوندی در بیماران مبتلا به پرکاری تیروئید و گروه کنترل نشان نداد (P=0/99).
بهطورکلی، شیوع سرمی عفونت با توکسوپلاسما در بیماران مبتلا به کمکاری تیروئید بیشتر از بیماران مبتلا به پرکاری تیروئید بود، اما همبستگی معنی داری مشاهده نشد (P=0/54). طبقهبندی بیشتر بیماران براساس جنسیت و گروههای سنی در کمکاری تیروئید و پرکاری تیروئید نیز تفاوت ناچیزی را بین بیماران و گروه کنترل نشان داد (P=0/05) (جدولهای شماره 2 و 3).


بحث و نتیجهگیری
انگل توکسوپلاسما گوندی ممکن است انسان و همچنین گونههای دیگر، ازجمله تمام مهرهداران را آلوده کند [4]. تاکی زوئیتهای انگل میتوانند ازطریق گردش خون به اندامهایی مانند غده تیروئید برسند و با ایجاد تغییرات بافتی، مانند هیپرپلازی بر عملکرد تیروئید تأثیر بگذارند که در اهمیت این مطالعه منعکس شده است [11]. تفاوت در میزان آلودگی به توکسوپلاسما تحت تأثیر آبوهوای گرم و مرطوب، آب آلوده، عوامل مرتبط با غذا (عادات بد آشپزی)، بهداشت بد و تماس با حیوانات ولگرد است که میتوانند ناقلان بالقوه انگل باشند [8]. بااینحال، ارتباط بین عفونت توسط انگل با غده تیروئید تا حد زیادی ناشناخته و نامشخص است. در مطالعه حاضر، شیوع توکسوپلاسموز نهفته در افراد شهر یزد و آنتیبادیهای IgG ضد توکسوپلاسما در بیماران مبتلا به کمکاری و پرکاری تیروئید در مقایسه با گروههای کنترل بررسی شد. براساس نتایج این مطالعه، متغیرهای جنس و سن در شیوع عفونت توکسوپلاسما و اختلال عملکرد تیروئید ارتباطی نداشتند. تحقیقات انجامشده در 88 کشور یک رابطه کلی مثبت بین شیوع توکسوپلاسموز نهفته و بروز اختلالات غدد درونریز را نشان داد [15]. علاوهبراین، عفونت توکسوپلاسموزیس در غده تیروئید در انسان [16] و سایر مهرهداران [1] گزارش شده است. توکسوپلاسموز با بیماریهای خودایمنی تیروئید [15، 17]، افزایش اتوآنتی بادیها علیه پراکسیداز تیروئید [14] و افزایش خفیف در سنتز هورمون تیروئید در دوران بارداری مرتبط است [17]. سلمان و همکاران، فراوانی (15/85 درصد) آنتی بادی را در سرم بیماران مبتلا به عملکرد غیرطبیعی تیروئید گزارش کردند که در آنها 13 درصد آنتیبادی IgG و 2/84 درصد آنتیبادی IgM ضد توکسوپلاسما مثبت بود [18, 19].
در مقابل آلوارادو ـ اسکوویل و همکاران گزارش کردند شیوع سرمی عفونت با توکسوپلاسما گوندی بیماران مبتلا به کمکاری تیروئید بین 31 تا 50 سال در مقایسه با افراد گروه کنترل بهطور قابلتوجهی کمتر بود و این ارتباط منفی غیرمنتظره بود [14].
ابود و الیزی گزارش کردند پاسخهای مثبت IgM و IgG توکسوپلاسما گوندی بهطور قابلتوجهی با جنسیت مرتبط است و تری یدوتیرونین و تیروکسین با پاسخ مثبت IgM ضد توکسوپلاسما در زنان همبستگی معکوس داشت و تفاوت معنیداری در سطح تری یدوتیرونین در بین مردان و زنان دارای آنتی IgM و IgG مثبت در سرم گزارش کردند. در این مطالعه نشان داده شد شیوع سرمی عفونت با توکسوپلاسما در بیماران مبتلا به کمکاری تیروئید بیشتر از بیماران مبتلا به پرکاری تیروئید بود، اما تفاوت معنیداری مشاهده نشد [20].
مطالعه دیگری برای تعیین ارتباط بین مثبت شدن سرمی عفونت توکسوپلاسما گوندی و بیماری تیروئید طراحی شد. از 176 بیمار، 161 نفر مبتلا به کمکاری تیروئید و 15 نفر مبتلا به پرکاری تیروئید ناشی از توکسوپلاسما گوندی بودند. بیماران به 2 گروه وابسته به سن یعنی 50 سال و 51 سال به بالا تقسیم شدند. اگرچه بین عفونت توکسوپلاسما گوندی و بیماری تیروئید همبستگی منفی وجود دارد. کمکاری تیروئید در بیماران جوانتر در مقایسه با گروه مسنتر مشاهده شد [21].
در مطالعه دیگری آیسر صالح محمد و همکاران برای تعیین اثر توکسوپلاسموز بر سطح هورمون تیروئید از تست الایزا استفاده کردند و یافتههای آنها نشان داد درمورد کمکاری تیروئید، افزایش معنیداری در سطح تیروتروپین و کاهش تیروکسین، تری یدوتیرونین و کلسیتونین در مقایسه با گروه کنترل مشاهده شد. از سوی دیگر، کاهش در سطح تیروتروپین و افزایش قابلتوجهی در سطوح تیروکسین، تری یدوتیرونین و کلسی تونین درمورد پرکاری تیروئید وجود داشت[22].
ملاحظات اخلاقی
پیروی از اصول اخلاق پژوهش
این مطالعه دارای تأییدیه اخلاقی به شماره (IR. bums. REC. 1399.174) از دانشگاه علومپزشکی بیرجند است.
حامی مالی
این مقاله با حمایت مالی معاونت تحقیقات دانشگاه دانشگاه علومپزشکی بیرجند انجام شده است.
مشارکت نویسندگان
مفهومسازی: رقیه نوروزی، ابوالقاسم سیادتپناه؛ روششناسی: رقیه نوروزی، سید جعفر عدنانی ساداتی؛ تحقیق: رقیه نوروزی، رضا احمدی؛ نگارش پیشنویس اصلی: رضا افضلیپور، جواد صادقینسب; نقد و ویرایش: رقیه نوروزی، احمد نگهبان؛ تأمین مالی، ابوالقاسم سیادتپناه؛ منابع: ابوالقاسم سیادتپناه؛ سرپرستی: رقیه نوروزی، ابوالقاسم سیادتپناه.
تعارض منافع
بنابر اظهار نویسندگان این مقاله تعارض منافع ندارد.
تشکر و قدردانی
نویسندگان از کلیه همکاران شاغل در معاونت تحقیقات و فناوری دانشگاه علومپزشکی بیرجند و بخش انگلشناسی برای کمکهای صورتگرفته تشکر و قدردانی میکنند.
References
1.Dubey JP, Darrington C, Tiao N, Ferreira LR, Choudhary S, Molla B, et al. Isolation of viable Toxoplasma gondii from tissues and feces of cats from Addis Ababa, Ethiopia. J Parasitol. 2013; 99(1):56-8. [DOI:10.1645/GE-3229.1] [PMID]
2.Asgari Q, Mehrabani D, Motazedian M, Kalantari M, Nouroozi J, Adnani Sadati S. The viability and infectivity of Toxoplasma gondii tachyzoites in dairy products undergoing food processing. Asian J Anim Sci. 2011; 5(3):202-7. [DOI:10.3923/ajas.2011.202.207]
3.Pappas G, Roussos N, Falagas ME. Toxoplasmosis snapshots: Global status of Toxoplasma gondii seroprevalence and implications for pregnancy and congenital toxoplasmosis. Int J Parasitol. 2009; 39(12):1385-94. [DOI:10.1016/j.ijpara.2009.04.003] [PMID]
4.Mohaghegh MA, Yazdani H, Hadipour M, Namdar F, Azami M, Kalani H, et al. Seroprevalence of Toxoplasma gondii infection among patients admitted to Al-Zahra Hospital, Isfahan, Iran. J Ayub Med Coll Abbottabad. 2015; 27(4):767-70. [PMID]
5.Omidian M, Asgari Q, Bahreini MS, Moshki S, Sedaghat B, Adnani Sadati SJ. Acute toxoplasmosis can increase serum dopamine level. J Parasitic Dis. 2022; 46(2):337-42. [DOI:10.1007/s12639-021-01447-1] [PMID]
6.Dubey JP. History of the discovery of the life cycle of Toxoplasma gondii. Int J Parasitol. 2009; 39(8):877-82. [DOI:10.1016/j.ijpara.2009.01.005] [PMID]
7.Scallan E, Hoekstra RM, Angulo FJ, Tauxe RV, Widdowson MA, Roy SL, et al. Foodborne illness acquired in the United States- Major pathogens. Emerg Infect Dis. 2011; 17(1):7-15. [DOI:10.3201/eid1701.P11101] [PMID]
8.Bresciani KDS, Galvão ALB, Vasconcellos ALd, Soares JA, Matos LVSd, Pierucci JC, et al. Relevant aspects of human toxoplasmosis. Res J Infect Dis. 2013; 1(1):1-7. [Link]
9.Asgari Q, Sarnevesht J, Kalantari M, Sadat SJ, Motazedian MH, Sarkari B. Molecular survey of Toxoplasma infection in sheep and goat from Fars province, Southern Iran. Trop Anim Health Prod. 2011; 43(2):389-92. [DOI:10.1007/s11250-010-9704-1] [PMID]
10.Dubey JP, Jones JL. Toxoplasma gondii infection in humans and animals in the United States. Int J Parasitol. 2008; 38(11):1257-78. [DOI:10.1016/j.ijpara.2008.03.007] [PMID]
11.Flegr J, Prandota J, Sovičková M, Israili ZH. Toxoplasmosis-a global threat. Correlation of latent toxoplasmosis with specific disease burden in a set of 88 countries. Plos One. 2014; 9(3):e90203. [DOI:10.1371/journal.pone.0090203] [PMID]
12.Zouei N, Shojaee S, Mohebali M, Keshavarz H. The association of latent toxoplasmosis and level of serum testosterone in humans. BMC Res Notes. 2018; 11(1):365. [DOI:10.1186/s13104-018-3468-5] [PMID]
13.Boelaert K, Franklyn JA. Thyroid hormone in health and disease. J Endocrinol. 2005; 187(1):1-15. [DOI:10.1677/joe.1.06131] [PMID]
14.Wasserman EE, Nelson K, Rose NR, Rhode C, Pillion JP, Seaberg E, et al. Infection and thyroid autoimmunity: A seroepidemiologic study of TPOaAb. Autoimmunity. 2009; 42(5):439-46. [DOI:10.1080/08916930902787716] [PMID]
15.Alvarado-Esquivel C, Torres-Castorena A, Liesenfeld O, García-López CR, Estrada-Martínez S, Sifuentes-Alvarez A, et al. Seroepidemiology of Toxoplasma gondii infection in pregnant women in rural Durango, Mexico. J Parasitol. 2009; 95(2):271-4. [DOI:10.1645/GE-1829.1] [PMID]
16.Liu DC, Lin CS, Seshan V. [AIDS complicated with disseminated toxoplasmosis: A pathological study of 9 autopsy cases (Chinese)]. Zhonghua Bing Li Xue Za Zhi. 1994; 23(3):166-9. [PMID]
17.Tozzoli R, Barzilai O, Ram M, Villalta D, Bizzaro N, Sherer Y, et al. Infections and autoimmune thyroid diseases: Parallel detection of antibodies against pathogens with proteomic technology. Autoimmun Rev. 2008; 8(2):112-5. [DOI:10.1016/j.autrev.2008.07.013] [PMID]
18.Stahl W, Kaneda Y. Impaired thyroid function in murine toxoplasmosis. Parasitology. 1998; 117 (Pt 3):217-22. [DOI:10.1017/S003118209800300X] [PMID]
19.Salman Y, Mustafa WG. Correlation between Toxoplasma gondii and Thyroid function hormone levels in sera of patients attending private clinics and laboratories in Kirkuk City. Int J Plant Biol. 2014; 1(4):299-306. [Link]
20.Al-Ezzy AIA, Abood WN. Immunoenocrinology Association of toxoplasma gondii and thyroid hormins in Iraqi Patients with clinical manifestatons of toxoplasmosis. Int J Pharma Bio Sci. 2016; 7(1):359-69. [Link]
21.Alvarado-Esquivel C, Ramos-Nevarez A, Guido-Arreola CA, Cerrillo-Soto SM, Pérez-Álamos AR, Estrada-Martínez S, et al. Association between Toxoplasma gondii infection and thyroid dysfunction: A case-control seroprevalence study. BMC Infect Dis. 2019; 19(1):826. [DOI:10.1186/s12879-019-4450-0] [PMID]
22.Al-Issawi TAM, Mohammed AS. Effects of Infection with Toxoplasma Gondii to the Levels of Thyroid Hormones. Eur J Mol Clin Med. 2020; 7(1):110-4. [Link]
نوع مطالعه: پژوهشي |
موضوع مقاله:
اپیدمیولوژی
دریافت: 1402/11/26 | پذیرش: 1402/12/16 | انتشار: 1403/1/13
دریافت: 1402/11/26 | پذیرش: 1402/12/16 | انتشار: 1403/1/13
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





